Na oncologia a oncoproteína, foi a classificação recebida pela proteína p53, ainda no fim da década de 70, quando foi descoberta, ao acaso, em extratos de oncoproteínas do Vírus SV40.
Atualmente sabemos que essa proteína é codificada pelo gene TP53, localizado no braço curto do cromossomo 17 (17p13.1), que o tamanho aproximado do gene é aproximadamente 20 kb e 11 exóns constituem a sua estrutura.
A proteína codificada pelo gene TP53 tem uma cadeia polipeptídica de 393 aminoácidos, um peso molecular de 53kDa, o que lhe atribui o nome. A estrutura da p53 é constituída por 5 domínios e dois sinais de localização subcelular: Nuclear localization signal (NLS) e Nuclear export signal (NES).
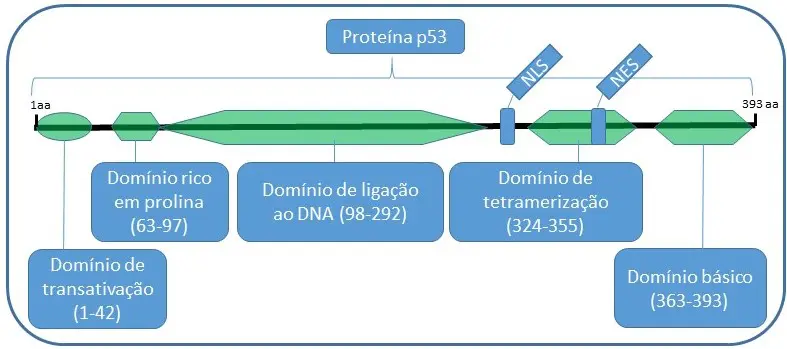
Dentre os 5 domínios existentes, o domínio de ligação ao DNA garante a especificidade da proteína em se ligar a genes alvos em respostas a diferentes estresses celulares.
Os diversos estudos que permitiram uma maior compreensão sobre a p53, foram fundamentais para reclassifica-la como proteína supressora de tumor, uma vez que é notável sua atuação na proteção da célula contra a tumorigênese.
A p53 é ativada em diversas alterações de estresse celular as quais fazem com que a proteína seja merecedora do título de “guardiã do genoma”.
Ao detectar um estresse celular ou erro no DNA, a p53 ativa diversos genes que levarão a diferentes respostas de supressão ao dano, assim sendo, p53 atua regulando negativamente o ciclo celular.
O tipo e duração do estresse, qual o tipo de tecido afetado e a extensão do dano causado ao DNA irão definir a melhor resposta supressora do tumor.
Considerando que p53 é um fator de transcrição, ela interage com diversos genes e essa interação varia com o tipo de célula e o contexto do estresse celular.
Alguns exemplos de respostas e seus respectivos genes ativados pela p53, podem ser elencados:
- Autofagia (DRAM):
- Apoptose (BAX; BBC3/PUMA, NOXA):
- Senescência (CDKN1A/p21; PAI1; PML)
- Reparo do DNA (DDB2; XPC; GADD45A)
- Parada do ciclo celular (CDKN1A/p21)
Proliferação celular e p53
É bem conhecido o fato de que antes da célula se dividir, o DNA precisa se replicar e é nesse momento que o material genético fica suscetível aos erros de replicação.
Muito embora as taxas de erros sejam bem diminutas, ainda assim, podem ocorrer erros e considerando também o fato de que diferentes enzimas devem trabalhar de forma orquestrada durante a replicação do DNA para que a célula filha seja exatamente igual a célula mãe, adicionar aproximadamente 3 bilhões de pb pode não ser tão simples assim, principalmente se o DNA é exposto a algum tipo de carcinógeno.
Como a “guardiã do genoma”, a p53 pode ser ativada a qualquer momento do ciclo celular, parando o ciclo e corrigindo possíveis erros de adição de nucleotídeos à molécula de DNA nascente.
Dependendo da extensão do erro e da impossibilidade de o corrigir, um dos principais mecanismos da p53 é colocado em prática, a apoptose celular ou a morte celular programada.
A apoptose celular impede que o erro ao DNA seja perpetuado nas células seguintes, pois a célula mutada se autodestrói! Mas é importante ressaltar que esse não é o único objetivo da apoptose celular, pois esse mecanismo também é bem natural e acontece como controle da densidade celular, regulando o tamanho dos tecidos.
Visto o conteúdo desse texto, vamos apenas contextualizar sobre a função da apoptose que é impedir que erros genéticos se perpetuem. Mas e o que acontece se a p53 falhar?
p53 disfuncional e tumorigênese
Alguns indivíduos já nascem com o gene TP53 danificado, como na Síndrome de Li-Fraumeni que predispõe indivíduos aos riscos de diversos tipos de câncer.
Uma condição autossômica dominante faz com que indivíduos com idades precoces (até os 45 anos), possam sofrer algum tipo de câncer.
A p53 disfuncional perde a capacidade de desencadear a apoptose e de corrigir erros ocorridos durante a replicação do DNA, deixando assim, o caminho livre para a tumorigênese. Mas não somente mutações herdadas, em células germinativas, podem acometer a p53.
Mutações adquiridas, em células somáticas, podem ocorrer ao longo da vida do indivíduo e quando essa mutação inativa a p53, a tumorigênese é inevitável.
Em cerca de 50 % dos casos de câncer, a p53 perde sua função, devido a mutações, que geralmente são do tipo missense (troca de nucleotídeo), mas também podem ocorrer outros tipos de mutação, embora sejam menos frequentes.
Os outros 50% dos casos de câncer, podem ser devidos a algum a algum tipo de inativação protéica devido a erros pós traducionais e isso inclui os cânceres de maiores incidência no Brasil mostrados na figura seguinte. Consulta feita em 02/01/2021
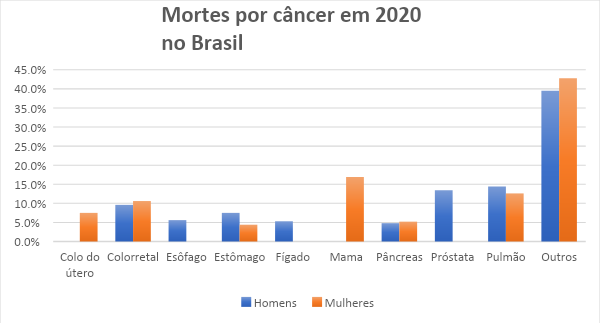
Referente a erros no gene TP53, estudos diversos mostram que, devido a padrões de mutação, foi possível estabelecer uma associação a carcinógenos, demonstrando a influência de agentes externos ao gene TP53 e que a maioria das mutações, ocorrem no domínio central de ligação ao DNA, resultando em uma proteína com a conformação alterada e uma inespecificidade de ligação ao DNA.
Importância de sequenciar TP53
Em casos, como na Síndrome de Li-Fraumeni, o sequenciamento do gene TP53 é recomendado para avaliar os possíveis riscos em gerações futuras.
Tumores em células somáticas também requerem o sequenciamento do TP53, pois dependendo da natureza da mutação e a região do gene mutado é possível definir uma melhor estratégia para intervenção ao tumor, personalizando a terapia a ser usada.
Em tratamentos de câncer, muitos dos quimioterápicos usados causam danos ao DNA a fim de promover a apoptose da célula tumoral, nesse caso, antes do tratamento, pressupõe que o gene TP53 ainda pode desempenhar a apoptose celular, caso seja estimulado.
No caso da mutação inativar de fato o gene TP53 na célula tumoral, o uso destes quimioterápicos será em vão e irão causar ainda mais instabilidades genômicas no paciente e como consequência, maiores sofrimentos.
Essa diferença de comportamento da p53 aos quimioterápicos estão ligadas ao tipo e local da mutação sofrida pelo gene, que pode variar dependendo em qual domínio for a mutação.
P53 como alvo terapêutico
Em resumo, a p53 é uma importante proteína supressora de tumor e a perda de sua função leva a célula a diversas outras instabilidades genômicas, o que por sua vez, desregula importantes mecanismos de controle do ciclo celular e como consequência, a célula prolifera de forma ilimitada e desgovernada. O tumor se instala!
É então compreensível o grande número de abordagens terapêuticas que visam a restituição do gene TP53 para a reversão de casos de câncer (aproximadamente 47 ensaios), principalmente depois do lançamento de dois medicamentos de terapia gênica, baseados na p53, pela China. Gendicine e Oncorine H101, para câncer de cabeça e pescoço e carcinoma de nasofaringe, respectivamente.
A restituição desse gene reestabelece os mecanismos de controle do ciclo celular e a apoptose. Atualmente, é grande o número de pesquisas de terapia gênica que se baseiam no gene TP53.
Conclusão
Diferentes tipos de tumores têm diferentes tipos de mutação no gene TP53. Essas mutações, ainda que estejam maioritariamente no domínio central, ainda assim podem variar de acordo com os nucleotídeos que forem trocados.
Isso leva a diferentes funções ou a inativação completa do gene e nesse caso, alguns quimioterápicos podem piorar a situação do tumor, causando mais mutações na célula.
Mutações que ocorrem em outros domínios podem acontecer, mas em menor proporção.
Considerando as mutações que podem ocorrer, é importante um sequenciamento desse gene antes que se inicie algum tratamento, pois esse sequenciamento prévio, pode ajudar nas decisões de estratégias para intervenção ao tumor, tornando o tratamento mais eficaz.
Referências
Azevedo, G. M. et al. (2019) ‘Effect of chromatographic conditions on supercoiled plasmid DNA stability and bioactivity’, Applied Sciences (Switzerland). doi: 10.3390/app9235170.
Chen, F., Wang, W. and El-Deiry, W. S. (2010) ‘Current strategies to target p53 in cancer’, Biochemical Pharmacology. doi: 10.1016/j.bcp.2010.04.031.
Donehower, L. A. et al. (2019) ‘Integrated Analysis of TP53 Gene and Pathway Alterations in The Cancer Genome Atlas’, Cell Reports. doi: 10.1016/j.celrep.2019.07.001.
Magluta, E. P. S. and Klumb, C. E. (2008) ‘Resistência ao tratamento no linfoma de Burkitt: associação com mutações específicas no gene TP53?’, Revista Brasileira de Hematologia e Hemoterapia. doi: 10.1590/s1516-84842008000100011.
Tanaka, T., Watanabe, M. and Yamashita, K. (2018) ‘Potential therapeutic targets of TP53 gene in the context of its classically canonical functions and its latest non-canonical functions in human cancer’, Oncotarget. doi: 10.18632/oncotarget.24611.
Toufektchan, E. and Toledo, F. (2018) ‘The guardian of the genome revisited: P53 downregulates genes required for telomere maintenance, DNA repair, and centromere structure’, Cancers. doi: 10.3390/cancers10050135.





